1.
PENDAHULUAN
1.1.
Latar Belakang
Teknik western blot, atau juga
disebut sebagai imunoblot telah sering digunakan untuk menganalisis protein
spesifik pada sampel. Western blot menggunakan gel elektroforesis untuk
memisahkan protein berdasarkan panjang polipeptida. Protein tersebut akan
ditransfer ke nitroselulosa atau PVDF dan diberi antibody spesifik untuk
identifikasi protein target (Burnette, 1981).
Saat ini, telah banyak reagen
antibody baik poliklonal maupun monoklonal untuk 10.000 jenis protein. Sehingga
western blot sangat bermanfaat untuk digunakan bersama antibody tersebut.
Metode ini awalnya ditemukan oleh George stark pada Universitas Stanford. Nama
western blot diberikan pada teknik tersebut oleh Neal Burnette and Sushant
Bhat, merupakan nama yang dimiripkan dengan teknik deteksi DNA southern blot
yang ditemukan Edwin southern dan Northern blot yang digunakan deteksi RNA
(Towbin et al., 1979)
1.2. Tujuan
Untuk mengetahui proses pelaksanaan western blot dan cara interpretasinya
2. METODE
2.1 Persiapan Sampel
Sampel bisa diambil
dari kultur sel maupun bagian dari jaringan. Untuk jaringan yang solid bperlu
dilakukan penghancuran menggunakna blender atau homogenizer. Detergen, garam
dan buffer juga bisa digunakan untuk melisiskan membrane sel. Protease dan
phospatase inhibitor diberikan untuk mencegah terjadinya pemecahan jaringan
dengan enzimnya sendiri. Perispan jaringan biasanya dilakukan apda suhu dingin
untuk mencegah degradasi protein. Untuk memisahkan komponen sel dengan organel,
dilakukan sentrifugasi.
Gambar 1. Langkah dalam persiapan
sampel western blot
Protein dari sampel diseparasi
mengunakan elektoforesis SDS page berdasarkan isoelektrik poin, berat molekul,
kelistrikan atau kombinasinya. SDS PAGE akan mempertahankan polipeptida dalam
bentuk denaturasi setelah dibersihkan dari struktur sekunder dan tersier
sehingga protein dapat dipisah berdasarkan berat molekul.
2.2
Transfer
Untuk membuat protein dari SDS page
bisa dideteksi oleh antibody, protein tersebut perlu ditransfer dari gel ke
membrane nitroselulosa atau polyindylidene difluoride (PVDF). Membrane tersbut
diletakkan di atas gel dan ditambahkan buffer. Protein akan masuk pada membrane
dan siap dideteksi dengan western blot (Renart et al., 1979)
Gambar 2. Langkah dalam SDS PAGE
Untuk mengecek
keseragaman dari transfer protein dari gel ke membrane dapat dicek dengan
pewarnaan commasie brilliant blue dan ponceau S .
2.3 Blocking
Blocking dilakukan untuk mencegah
antibody sekunder bereaksi dengan protein non spesifik yang masuk pada sampel.
Blocking biasanya menggunakan BSA atau susu skim tanpa lemak pada TBS.
pemberian Tween 20 atau Tritonn X-100 dapat memperjelas hasil final dari
western blot mengurangi false positif
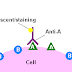
2.4 Deteksi Dua
Langkah
Pada saat deteksi membran dengan
antibody, untuk deteksi dua langkah dilakukan persiapan antibody primer yang
dibentuk dari produksi mandiri. Antibody primer dengan antigen yang di inginkan
diberikan sesuai dengan sampelnya. Antibody primer yang digunakan pada sampel
ini ialah antibody poliklonal terhadap protein Shigella 49kDa. Solusi antibody
dan membran dapat disimpan setelah itu
diberikan antibody sekunder yang berikatan dengan antibody primer. Sehingga
dengan bantuan horseradish peroxidase akan terjadi luminasi sesuai dengan
jumlah protein.
Gambar 2. Langkah dalam Western blot
3. HASIL
Gambar 1. Pita Protein yang Terbentuk
Regresi Linier
NO
|
BM MARKER
|
JARAK TRACKING
|
LOG BM
|
RF
|
1
|
260
|
5
|
2.414973
|
0.075758
|
2
|
135
|
8
|
2.130334
|
0.121212
|
3
|
95
|
10
|
1.977724
|
0.151515
|
4
|
72
|
12.5
|
1.857332
|
0.189394
|
5
|
52
|
18
|
1.716003
|
0.272727
|
6
|
42
|
22.5
|
1.623249
|
0.340909
|
7
|
34
|
27
|
1.531479
|
0.409091
|
8
|
26
|
33
|
1.414973
|
0.5
|
9
|
17
|
43.5
|
1.230449
|
0.659091
|
10
|
10
|
60
|
1
|
0.909091
|
RF = jarak tracking / jarak total, dimana jarak total yakni 66
mm
Gambar 2.0 Grafik regresi Linier Kurva Standar Marker
Sampel 1. OMP Shigella
JARAK TRACKING
|
RF
|
LOG BM
|
BM
|
8
|
0.121212
|
2.09745
|
125.1555
|
12.5
|
0.189394
|
1.982472
|
96.04445
|
13.5
|
0.204545
|
1.956922
|
90.55692
|
14.25
|
0.215909
|
1.937759
|
86.64803
|
34.5
|
0.522727
|
1.420359
|
26.32442
|
38.5
|
0.583333
|
1.318156
|
20.80445
|
Sampel 2. Pili Shigella
JARAK TRACKING
|
RF
|
LOG BM
|
BM
|
34.5
|
0.522727
|
1.420359
|
26.32442
|
38.5
|
0.583333
|
1.318156
|
20.80445
|
5.
KESIMPULAN
Teknik western blot, atau juga
disebut sebagai imunoblot telah sering digunakan untuk menganalisis protein
spesifik pada sampel. Western blot menggunakan gel elektroforesis yang
ditranfer pada nitroselulosa atau PVDF dan diberi antibody spesifik untuk
identifikasi protein target. Pada praktikum ini pemberian antibody poliklonal
Shigella 49 kDa mengalami kros reaksi pada sampel OMP Shigella dengan BM 125,
96, 90, 86 dan 26 kDa sedangkan pada pili kros reaksi terjadi pada 26 dan 20
kDa.
DAFTAR
PUSTAKA
Burnette WN. 1981. "'Western blotting': electrophoretic
transfer of proteins from sodium dodecyl sulfate—polyacrylamide gels to
unmodified nitrocellulose and radiographic detection with antibody and
radioiodinated protein A". Analytical Biochemistry 112 (2):
195–203.
Towbin H, Staehelin T, Gordon J. 1979. "Electrophoretic transfer of proteins from polyacrylamide gels to
nitrocellulose sheets: procedure and some applications". Proceedings of the National Academy of Sciences USA 76
(9): 4350–54
Renart J, Reiser J, Stark GR. 1979. "Transfer of proteins from gels to diazobenzyloxymethyl-paper and
detection with antisera: a method for studying antibody specificity and antigen
structure". Proceedings of
the National Academy of Sciences USA 76 (7): 3116–20.
![]()